- 技术文章
细胞趋化实验新方法:可实时观察细胞动态
2016-04-26 17:10:01 来源:
细胞趋化性(Chemotaxis,亦被称为化学趋向性)是趋向性的一种,指细胞、细菌及其他单细胞、多细胞生物依据环境中某些化学物质而趋向的运动。趋化性对细胞的发展和其他正常功能一样不可或缺。
在这里,我们以小鼠树突状细胞为例,介绍一个细胞的化学趋化实验。
一、实验材料准备:
- 仪器:
- 细胞培养箱(高湿度,37℃,5%CO2)
- 倒置显微镜,具有10X相差物镜和定时拍照功能
- 镜载加热孵育系统(37℃,5%CO2)
- 可选配置:全自动载物台,自动对焦系统
- 分析软件:可选用手动分析软ImageJ的“Manual Tracking”模块,或全自动的ibidi提供的WimTaxis进行细胞轨迹追踪。*后使用ibidi公司的“Chemotaxis and Migration Tool” 进行数据统计分析。
- 树突状细胞:
为了减少ibidi细胞趋化载玻片与培养基中的气泡,将载玻片和培养基提前24小时放入培养箱中
将8-10天的树突状细胞用200 ng/ml LPS 过夜处理(培养基等试剂见表一)
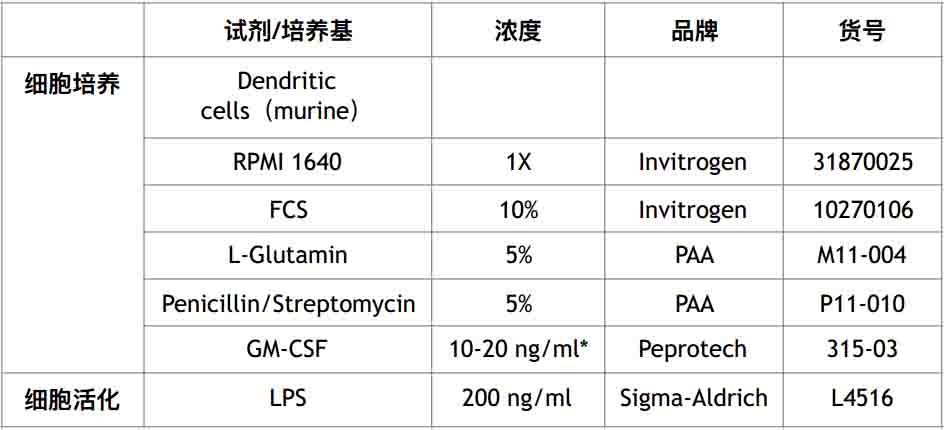
表一:细胞培养和活化所需的试剂盒培养基
*Lutz, M. B. et al. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J. Immunol. Methods 223, 77–92 (1999)
-
基质胶制备,Collagen I,bovine,1.6mg/ml
树突状细胞的化学趋化实验所需的试剂如下:
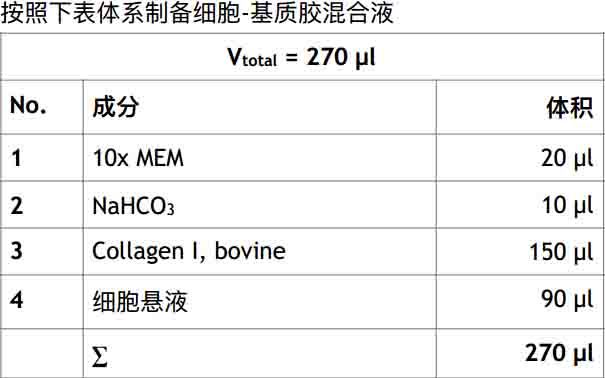
表三:制备1.6mg/ml 基质胶
操作步骤:
- 使用表一中的培养基制备 9 x 106 cells/ml 的细胞悬液
- 在1.5ml离心管中小心混匀表三中的1和2号试剂,避免产生气泡
- 在另一1.5ml离心管中准备150 μl collagen
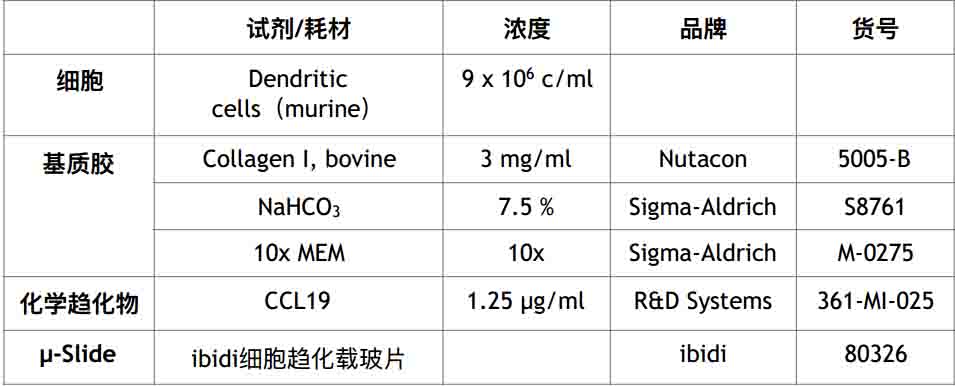
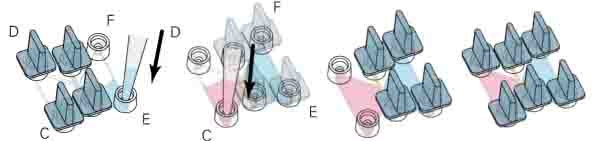
- 使用200μl枪头从第二步的混合液中吸取30μl(图一A)
- 小心混匀(图一B),避免产生气泡
- 加入90μl细胞悬液到上一步混合液中(图一C)
- 小心混匀(图一D),避免产生气泡
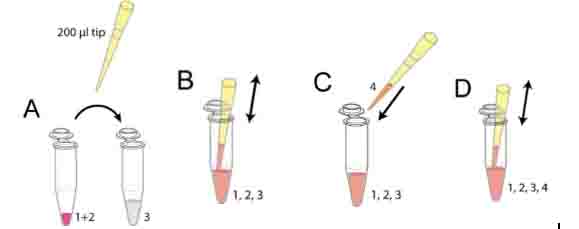
图一:制备细胞-基质胶混合液图示,注意:1)避免产生气泡,气泡会破坏胶原纤维,不能使用Vortex;2)胶原混合后,离胶凝大约有5分钟时间,如果在凝胶后再进行操作会破坏胶原纤维;3)当刚加10x MEM到NaHCO3中的时候会看到颜色变化,这表明没有充分反应,因此加入混合液到胶原蛋白中后要充分混匀。
-
细胞趋化实验
- 趋化试剂
- 化学趋化物:CCL 19(1.25 μg/ml in RPMI 1640/10%FCS)
- 无化学趋化物培养基:RPMI1640,10%FCS
- 实验步骤
- 当细胞-基质胶混合液制备好后直接加入ibidi细胞趋化载玻片的中间通道中(图二)
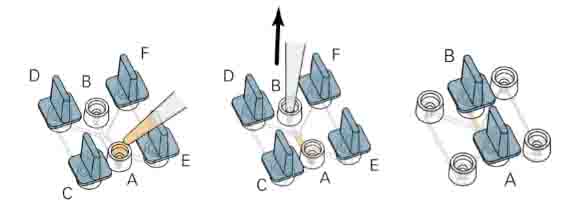
图二,在观测通道中加入细胞-基质胶混合液
- 将细胞趋化载玻片放入培养箱中30-35分钟,等待胶原蛋白凝固
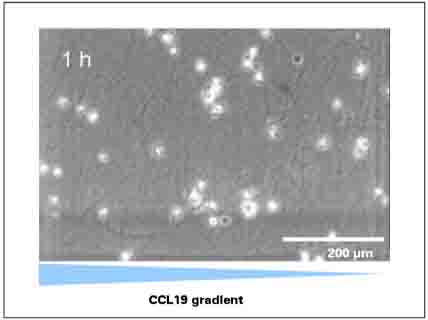
图五:明场1小时处图像采集,由于是3D培养环境,不是所有的细胞都能被清楚的成像。
- 图像处理
- 手动细胞轨迹追踪
- 下载ImageJ,并安装Manual Tracking模块
- 导入采集的系列图像到ImageJ中,打开模块“Manual Tracking”,选择“Add track”开始记录细胞轨迹
- 选择一个细胞,按照时间点单击细胞,*点击后,会有新窗口跳出来显示初始位置,以后每次点击,都将在这个新窗口中产生一个该细胞随着时间的新坐标
- 统计完足够的细胞轨迹后,保存轨迹坐标表格
- 至少收集30个细胞的轨迹才具有统计学意义,避免同一细胞追踪两次,去除由于凋亡会而不能采集完整的轨迹的细胞
- 可以将“Overlay dots & lines”以.avi格式导出
2)全自动细胞轨迹追踪
使用ibidi的WimTaxis自动分析平台,将采集的系列图像上传到该平台,几个工作日后,会得到细胞轨迹的坐标表格数据结果。
四、数据处理
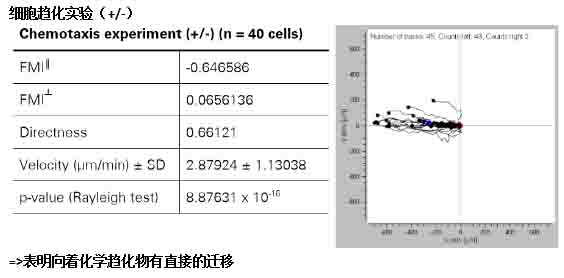
使用迁移指数( Forward Migration Indices*,FMIs)作为比较趋化实验和对照试验的参数。在有趋化物的情况下,空白对照的FMI和与趋化物垂直方向的化学趋化的迁移指数(FMI┴)应是在0点左右。而与趋化物平行方向的化学趋化的迁移指数(FMI‖)与0点有显著的区别表现出了化学趋向性。同时,使用Rayleigh Test**对细胞趋化的方向性进行检验。如果p值大于0.05表示了细胞运动的无序性,表明没有方向性的迁移。此外,迁移速率等参数也能直接用于分析。
*Foxman et al. Integrating conflicting chemotactic signals. The role of memory in leukocyte navigation, J Cell Biol 147, 577-588 (1999)
**Fisher, N. I. Statistical Analysis of Circular Data, Cambridge University Press, New York (1993)
五、统计结果:
-
产品分类
-
研磨机配件
-
轨道式摇床/微型离心机
-
多样品组织研磨机
-
全自动样品快速研磨仪
-
低温组织研磨仪
-
多样品冷冻研磨仪
-
高通量组织研磨机
-
快速组织细胞破碎仪
-
锤式旋风磨
-
多通道微生物磁珠匀浆仪
-
手持式高速匀浆机
-
小型珠磨仪
-
拍打式样品均质器
-
高速组织捣碎匀浆机
-
垂直混合仪
-
雪花制冰机
-
超声波粉碎机/微波反应仪
-
空气制冷仪(冷气仪)
-
萃取装置
-
杂交仪/融合仪/交联仪
-
研磨珠/研磨管/加珠枪
-
恒温金属浴/氮吹仪/混匀仪
-
轨道式摇床
-
微孔板/酶标板专用仪器
-
德国ibidi
-
Nanolive
-
天平
-
土壤/高能行星式研磨机
-
振动筛设备
-
菌种保存管
-
漩涡混合器
-
摇床
-
毛发毒品检测仪
-
水质监测仪
-
QuEChERS前处理一体机
-
土壤/高能行星式研磨机
-
三维振动球磨仪
-
臼式研磨机
-
叶绿素A研磨仪
-
毛发毒品检测仪
-
高效振动盘式研磨仪
-
点焊机
-
LCI 韩国
-
接种环灭菌/指示剂培养器
-
PCR仪/封膜仪
-
拓赫机电
-
代理品牌
-
科研者系列产品
-
超声波清洗机
-
拓赫组织捣碎机
-
高压均质机
-
离心浓缩仪
-
顶置搅拌机
-
智能分析工作站
-
三维混料仪
-
多功能分析仪
-
-
公司相册
-
组织细胞破碎仪
19张图片
-
 扫一扫,手机浏览
扫一扫,手机浏览